Cualquier persona trabajadora conoce el triángulo del fuego. Es una de las lecciones del curso de prevención de riesgos laborales que se imparte en empresas: los ingredientes del fuego son combustible, una fuente de calor y comburente (oxígeno). Al eliminar a uno de ellos, extingues el fuego, pero no vamos a volver a hablar de ellos. Los químicos en el incendio son el personal de análisis una vez apagado todo.
El líquido inflamable empleado como iniciador de el fuego no se consume completamente en el incendio. Es absorbido por los materiales del escenario y se mantienen bajo las llamas a una temperatura menor. El combustible que arde son los vapores del líquido inflamable que ascienden afectando a plantas superiores. Para determinar qué tipo de acelerante inflamable se ha utilizado, el químico usa la técnica de separación cromatografía de gases acoplada a un detector específico.
La muestra sólida absorbente recogida en el escenario se pretrata disolviéndola para poder ser inyectada en el cromatógrafo. Este disolvente no debe intervenir en el análisis, por eso la preparación de muestra es crucial. También se recogen pequeñas muestras líquidas sospechosas de haber iniciado la reacción para poder diferenciar sustancias como queroseno (hidrocarburos de 12 a 15 Carbonos) y gasolina (hidrocarburos de 4 a 12 Carbonos). Ambas son hidrocarburos obtenidos del petróleo por craking por diferencia de Temperaturas de destilación (300 y 200ºC respectivamente). La diferencia entre la Temperatura de ebullición y la polar del analito o compuesto a analizar es clave para identificarlo y atrapar al culpable. Además de eso, el químico usará un patrón interno con la sustancia pura a determinar para comparar la señal del detector.
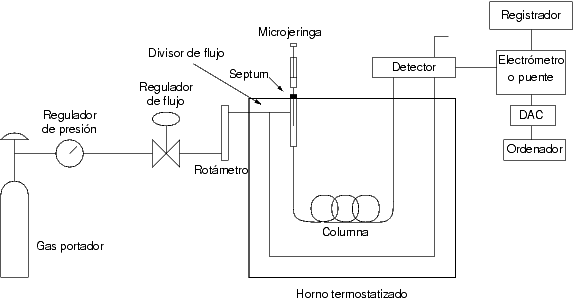
La ruta que sigue el analito por el cromatógrafo empieza por el inyector, fase en la que se evapora la muestra líquida y la introduce en la columna. Un gas inerte como el Helio hace fluir por la columna para que entre en contacto con la fase estacionaria, donde se separarán los compuestos por interacción con dicha fase. Esta parte de la ruta es calentada, dando el pistoletazo de salida hacia el detector. ¿quién llegará antes?,¿el más volátil?, ¿ el más polar?.

El más rápido en llegar al detector será el compuesto con el punto de ebullición más bajo, como en la destilación de aguardiente, que desperdiciamos el metanol inicial. Sí, compuesto con punto de ebullición más bajo es más volátil, más fácil de pasar a estado gaseoso. Pero también los compuestos con diferente polaridad con la fase estacionaria, serán campeones récord en tiempo de retención más corto (desde inyección hasta señal de respuesta en detección).
La ruta termina en el detector, es ahí donde se mide una señal cuantificable, un cromatograma o gráfico de datos como electrocardiograma del culpable, en vilo por conocer su imputación en la investigación.

Una determinación más eficaz del método analítico es la cromatografía de gases acoplada espectrometría de masas. El químico recoge la muestra sólida en un contenedor sellado capaz de atrapar gases. Éstos son inyectados en el cromatógrafo, son transportados igualmente por el capilar por el gas inerte, son ionizados según llegan en fase gaseosa y son desviados por el campo magnético de un imán por su relación carga y masa.

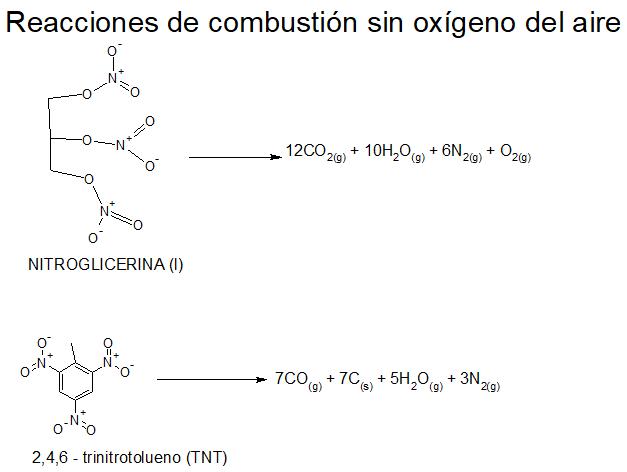
Esta técnica también la utiliza el químico para detectar explosivos, capaces de provocar reacciones de combustión sin oxígeno.
Los químicos estamos detrás de todo. Podemos ser culpables o jueces, no te olvides cuando nos tengas cerca.